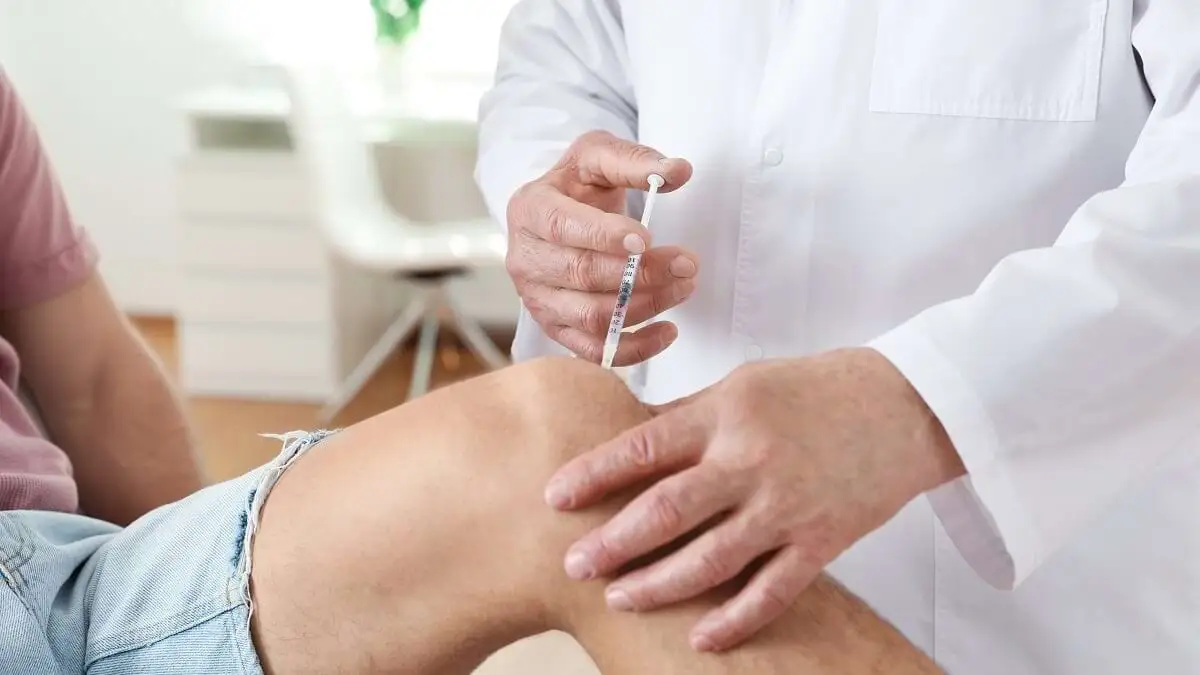
FDA a dat undă verde joi terapiei dezvoltate de Takeda Pharmaceutical pentru tratarea unei afecțiuni rare a sângelui întâlnită la pacienții adulți și pediatrici.
Adzynma (ADAMTS13, recombinant-krhn), creat de compania bio-farmaceutică japoneză, reprezintă primul tratament aprobat disponibil pentru pacienții suferind de purpură trombotică trombocitopenică congenitală (TTP), o boală genetică rară, cu simptome cronice debilitante și potențial letale.
Această afecțiune conduce la o coagulare anormală în vasele de sânge mici din întregul corp și este asociată cu anemie și niveluri scăzute de trombocite. Potrivit FDA, cele mai întâlnite efecte secundare ale acestei terapii includ dureri de cap, diaree, migrene, dureri abdominale, greață, infecții ale tractului respirator superior, amețeli și vărsături.
Decizia autorității de reglementare din domeniul sănătății se bazează pe rezultatele unui studiu avansat al medicamentului, care a arătat o reducere cu 60% a incidenței trombocitopeniei, simptomul cel mai comun al bolii, asociat cu un nivel scăzut de trombocite, în comparație cu tratamentul standard.
Tratamentul, denumit chimic TAK-755, contribuie la înlocuirea proteinei deficitare ADAMTS13, implicată în procesul de coagulare a sângelui la locul leziunilor, conform informațiilor furnizate de Reuters.
În prezent, tratamentele utilizate pentru încetinirea sau tratarea acestei afecțiuni implică terapii cu plasmă, intervenții chirurgicale la nivelul splinei și utilizarea medicamentului Rituxan al Roche, destinat tratării cancerului de sânge, dar utilizat și în afecțiunile trombotice.
Terapia a primit deja desemnarea de medicament orfan din partea Agenției Europene a Medicamentului (EMA) pentru tratamentul TTP, conform declarațiilor Takeda, care încă nu a dezvăluit prețul acestei terapii.
Sursă: 360medical.ro
Mai multe știri pe republikanews.ro.
Ne găsești pe pagina de Facebook RepublikaNews.